COVID-19 - Pedido de Aprovação
Sanofi e GSK buscam autorização regulatória para vacina contra a COVID-19
- Análise final do estudo global de reforço (VAT02) confirma a universalidade da capacidade de aumentar os anticorpos neutralizantes de 18 a 30 vezes quando é utilizada como reforco em indivíduos vacinados com as plataformas de mRNA e adenovírus;
- No ensaio de fase 3 de série primária (VAT08), duas doses da vacina Sanofi GSK em populações soronegativas demonstraram:
- 100% de eficácia contra a doença grave ehospitalizações por COVID-19;
- 75% de eficácia contra a doença COVID-19 moderada ou grave;
- 57,9% de eficácia contra qualquer doença sintomática por COVID-19, de acordo com a eficácia esperada da vacina no ambiente de hojedominado por variantes de preocupação.
- Perfil de segurança favorável seguindo tanto a série primária quanto a vacinacao de reforço.
Sanofi e GSK anunciaram no 23 de Fevreiro que pretendem enviar os dados do estudo de reforço e do estudo de eficácia de Fase 3 como base para as aplicações regulatórias de sua vacina contra a COVID-19.
A relevância para a saúde pública da vacina Sanofi-GSK à base de proteína com adjuvante estável à temperatura do refrigerador é fortemente apoiada pela indução de respostas imunes robustas e um perfil de segurança em várias situacões. Em participantes que receberam uma série primária de uma vacina desenvolvida em uma plataforma de mRNA ou adenovírus autorizadas, a vacina de Sanofi-GSK utilizada como reforço, induziu um aumento de anticorpos neutralizantes de 18 a 30 vezes em todas as plataformas de vacinas e faixas etárias. Quando a vacina Sanofi-GSK foi usada como uma série primária de duas doses seguida de uma dose de reforço, os anticorpos neutralizantes aumentaram 84 a 153 vezes em comparação com os níveis de pré-reforço (ver Figuras 1a e 1b para detalhes).
Thomas Triomphe, vice-presidente executivo da Sanofi Vaccines, disse: “Estamos muito satisfeitos com esses dados, que confirmam nossa forte ciência e os benefícios de nossa vacina contra a COVID-19. A vacina Sanofi-GSK demonstra uma capacidade universal de inducir uma resposta de reforço em todas as plataformas e todas as idades estudadas . Nós também observamos uma eficácia robusta da vacina quando foi utilizada na série primária no ambiente epidemiológico desafiador atual. Nenhum outro estudo global de eficácia de Fase 3 foi realizado durante este período com a circulação de muitas variantes de preocupação, incluindo a Ômicron, e esses dados de eficácia são semelhantes aos recentes dados clínicos com as vacinas autorizadas”.
Roger Connor, presidente da GSK Vaccines, disse: “A evolução da epidemiologia da COVID-19 demonstra a necessidade de uma variedade de vacinas. Nossa vacina candidata a base de proteína com adjuvante usa uma abordagem bem estabelecida que tem sido amplamente aplicada para prevenir a infecção com outros vírus incluindo a gripe pandêmica. Confiamos em que esta vacina pode desempenhar um papel importante na medida que continuamos enfrentando esta pandemia e nos preparando para o período pós-pandemia”.
Quando usada como uma série primária de duas doses, a vacina Sanofi-GSK forneceu níveis robustos de anticorpos neutralizantes, com GMTs atingindo 3711 unidades. Para comparação, um painel de soros de voluntários da mesma faixa etária que receberam duas doses de uma vacina já aprovada e altamente eficaz de mRNA apresentou um GMT de 1653 unidades, medido simultaneamente no mesmo laboratório.
Os dados do estudo de eficácia VAT08 mostraram que duas doses da vacina Sanofi-GSK geraram uma eficácia de 57,9% (intervalo de confiança de 95% [CI, 26,5, 76,7]) contra qualquer doença por COVID-19 sintomática na população soronegativa. A vacina Sanofi-GSK forneceu 100% de proteção (0 vs 10 casos pós-dose 1, 0 vs 4 casos pós-dose 2) contra doença grave e hospitalizações e 75% de eficácia (3 vs 11 casos) contra doença moderada a grave em populações soronegativas. Enquanto sequenciamento ainda está em andamento, os dados iniciais indicam 77% de eficácia contra qualquer variante Delta associada a COVID-19 sintomática, em línea com a efectividade vacinal esperada.
Em ambos os estudos, a vacina Sanofi-GSK foi bem tolerada em adultos, jovens e idosos sem preocupações de segurança.
As empresas estão em discussões com autoridades regulatórias, incluindo a FDA dos EUA e a European Medicines Agency (EMA), e planejam enviar a totalidade dos dados gerados com esta vacina candidata para dar suporte as autorizações regulatórias.
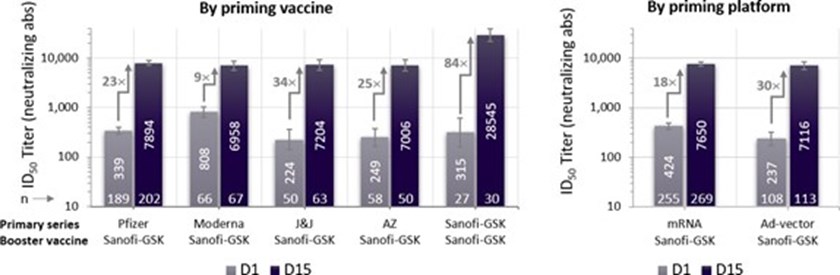
Figura 1a - Títulos de anticorpos neutralizantes pré vs pós-reforço em participantes de 18-55 anos de idade. Títulos Médios Geométricos (GMT) (95% CI).
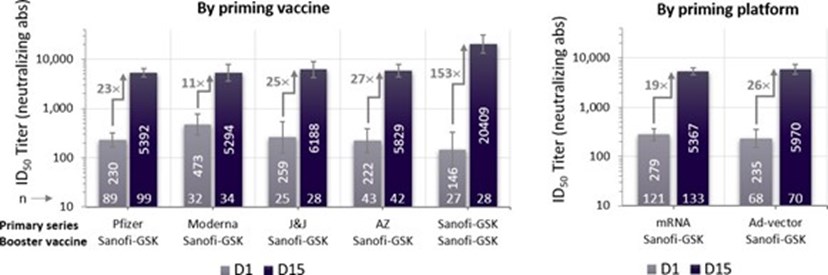
Figura 1b - Anticorpo neutralizante pré vs pós-reforço em participantes com ≥56 anos de idade. Títulos Médios Geométricos (GMT) (95% CI).
Para avaliar a imunogenicidade da vacina Sanofi-GSK como reforço, amostras de soro imunológico humano foram testadas pela Monogram Biosciences [San Francisco, CA] usando um teste padronizado de neutralização de pseudovírus (pVNT) aprovado pela FDA contra o vírus protótipo D614G.
Sobre VAT08 e VAT02
O estudo de Fase 3, VAT08, está avaliando uma formulação de antígeno de 10µg da vacina à base de proteína recombinante com adjuvante SARS-CoV-2 quanto à eficácia, imunogenicidade e segurança em comparação com um placebo.
O primeiro estágio do estudo está avaliando a eficácia de uma formulação de vacina contendo a proteína spike contra o vírus original D614 (parente) em mais de 10.000 participantes >18 anos de idade, aleatorizados para receber duas doses de 10µg de vacina ou placebo no dia 1 e dia 22 em centros nos EUA, Ásia, África e América Latina. Enrolamento concluído recentemente para uma segunda etapa do estudo, avaliando uma segunda formulação bivalente, incluindo a proteína spike da variante B.1.351 (Beta). O ensaio de Fase 3 segue os resultados iniciais positivos de um ensaio clínico de Fase 2 (VAT00002). Nesse estudo, a vacina candidata para COVID-19 foi administrada a 722 adultos para avaliar a segurança, reatogenicidade e imunogenicidade de 2 doses e identificar uma dosagem ideal para uso como reforço. Os resultados mostraram fortes taxas de resposta de anticorpos neutralizantes com 95% a 100% de soroconversão após uma segunda injeção em todas as faixas etárias (18 a 95 anos), em todas as doses.
Os resultados completos dos estudos VAT08 e VAT02 serão publicados ainda este ano.
Esses esforços são apoiados por fundos federais da Autoridade de Pesquisa e Desenvolvimento Biomédico Avançado, parte do escritório do Secretário Adjunto de Preparação e Resposta do Departamento de Saúde e Serviços Humanos dos EUA em colaboração com o Escritório Executivo do Programa Conjunto do Departamento de Defesa dos EUA para Defesa Química, Biológica, Radiológica e Nuclear sob o Contrato nº W15QKN-16-9-1002 e pelo Instituto Nacional de Alergia e Doenças Infecciosas (NIAID). O NIAID fornece financiamento para o Centro de Operações e Liderança da Rede de Ensaios de Vacinas contra o HIV (HVTN) (UM1 AI 68614HVTN), o Centro de Gerenciamento de Estatísticas e Dados (UM1 AI 68635), o Centro de Laboratórios HVTN (UM1 AI 68618), os Ensaios de Prevenção do HIV.
Centro de Operações e Liderança de Rede de Testes (UM1 AI 68619), o Centro de Operações e Liderança do Grupo de Ensaios Clínicos da AIDS (UM1 AI 68636), e o Consórcio de Pesquisa Clínica em Doenças Infecciosas (UM1 AI 148684, UM1 AI 148450, UM1 AI 148372 , UM1 AI 148574).
Declaração de advertência sobre declarações prospectivas:
A GSK adverte os investidores que quaisquer declarações ou projeções prospectivas feitas pela GSK, incluindo aquelas feitas neste anúncio, estão sujeitas a riscos e incertezas que podem fazer com que os resultados reais sejam materialmente diferentes dos projetados. Esses fatores incluem, mas não estão limitados a aqueles descritos no Relatório Anual da Empresa no Formulário 20-F para 2020, os resultados do quarto trimestre de 2021 da GSK e quaisquer impactos da pandemia de COVID-19.
Registrado na Inglaterra e País de Gales:
No. 3888792
Escritório registrado: 980 Great West Road Brentford, Middlesex TW8 9GS



